版权声明网站所载数据,包括但不限于文字报导、商标、图表图片、设计、网页上的照片、产生网页的程式码及其他构成这些网页内容的载体、文件及设计,均受到《中华人民共和国著作权法》、《中华人民共和国商标法》及其他法律法规和国际条约的保护。上述内容的知识产权属于本公司及网站,或其他授权本网站使用的内容提供者。任何个人或企业不得以商业目的转载使用,其它媒体或网站转载请注明来源于英文特生物技术(北京)有限公司网站www.inventchina.cn。非经本公司同意或授权,不得对本网站内容进行修改、复制、抄袭、剽窃、贩卖、展示、公开、散播或是将其用于任何商业目的。补充:① 本网站之上述声明以及其解释权、修改权、更新权均属本公司;② 本公司的浏览人员、加盟和参与本公司活动的人员、本公司项目服务的客户、与本公司进行合作的的单位和个人均在本公司“用户”之列,只有在接受和认可本声明的各项条款的条件下才能使用和浏览本网站;③ 涉及专项咨询或者针对特定客户、或者大型的专项服务,以双方签订的书面协议为权利、义务、责任依据;④ 未经本站声明明确授予的任何权利均予保留;⑤ 本站点所提到的真实的公司和产品的名称可能是其各自所有者的商标。



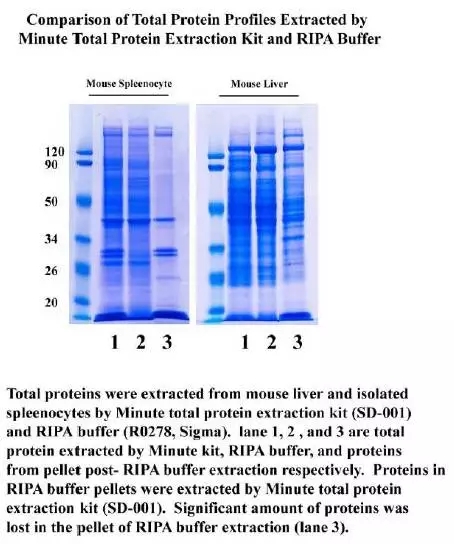

 站内热点
站内热点