IP(免疫沉淀,Immunoprecipitation)和 Co-IP(免疫共沉淀,Co-immunoprecipitation)都是利用抗体-抗原特异性结合的原理,从复杂样品中富集目标蛋白(IP)或验证蛋白-蛋白相互作用(Co-IP)。两者的核心机制相同,但实验目的有所区别。
示意图:
目标X蛋白(抗原) +抗X抗体 + Protein A/G beads → 形成复合物 → 洗涤 → 洗脱 → 检测X蛋白
关键点:
示意图:
X-Y复合物 + 抗X抗体 + Protein A/G beads→ 复合物被沉淀 → 洗涤 → 洗脱→检测X蛋白(IP)和Y蛋白(Co-IP)
步骤1:样品制备
收集细胞或取组织样品用预冷PBS洗2次。
选择合适的裂解液配方和提取方法,提取天然有活性的总蛋白样品(裂解物)。留取少量裂解物以备Western blot分析(Input对照)。
步骤2:预清除(可选)
在裂解物中加入IgG或空白微珠,4°C旋转孵育1小时。
4°C离心10分钟去除非特异结合蛋白,以减少背景,将上清转入新的离心管中进行后续实验。
步骤3:免疫沉淀
在裂解物中加入特异性抗体(1–5 μg),4°C孵育过夜。
加入预处理的Protein A/G微珠(30–50 μL),继续孵育2–4小时。
步骤4:洗涤
4°C离心(1000–3000 X g,5分钟)将protein A/G-beads离心至管底,弃上清。用洗涤缓冲液(如TBST)洗涤protein A/G-beads 3–4次,每次4℃旋转5分钟,彻底去除非特异结合。清洗后尽量去除残留液体。
步骤5:洗脱
方法A(变性洗脱):加入2×SDS上样缓冲液,95°C煮沸5分钟,离心取上清。
方法B(非变性洗脱):0.2 M 甘氨酸(pH 2.6)洗脱10分钟,立即用Tris-HCl(pH 8.5)中和
步骤6:SDS-PAGE, Western blotting或进行质谱分析
Western Blot检测
必须包括:Input(阳性对照)、IgG同型对照(阴性对照)、空载/敲除/敲低对照(验证特异性)。可选对照:仅含微珠对照
1. Input(阳性对照)
定义:实验开始时,未经过IP步骤、直接保存的细胞裂解液样本(通常取总量的5%-10%)。
作用:
*验证目标蛋白是否表达:确认细胞中确实存在Protein X和Protein Y。
*标准化信号强度:用于计算IP效率(如“Protein X在IP样本中的富集倍数”)。
*排除假阴性:若Input中无信号,可能是抗体或细胞裂解问题。若Input中看到目的蛋白信号,但在IP样品中没检测到,则表明抗体正常工作,IP富集失败。
Input是IP实验结果解读的重要标准,每次实验务必准备Input样本对照。
2. IgG同型对照(阴性对照)
定义:使用与一抗相同种属、相同亚型的非免疫抗体(如正常小鼠IgG)进行的平行IP实验。
作用:
*排除非特异性结合:若IgG组检测到Protein Y(或珠子背景信号),说明互作可能是假阳性。
*评估抗体特异性:确保目标蛋白的富集是依赖特异性抗体,而非Fc段或珠子非特异吸附。
3. 仅含微珠对照(可选的额外阴性对照)
定义:在Co-IP实验中,仅用Protein A/G微珠(不加任何抗体)孵育细胞裂解液的阴性对照组。
作用:
*排除微珠非特异吸附:检测是否有蛋白(如Protein X或Protein Y)直接吸附在微珠表面(无抗体介导)。若此组检测到信号,说明微珠本身导致假阳性,需优化洗涤条件或更换微珠。
*验证抗体依赖性:结合IgG同型对照,可区分“微珠背景”与“抗体非特异结合”。
实验方案-对照设置
|
组别
|
裂解液
|
抗体
|
微珠
|
预期结果
|
|
Input
|
+
|
-
|
-
|
强信号(验证蛋白表达)
|
|
IP组
|
+
|
抗Protein X
|
+
|
强信号(阳性互作)
|
|
IgG对照
|
+
|
同型IgG
|
+
|
无信号(排除抗体非特异)
|
|
Beads-only
|
+
|
-
|
+
|
无信号(排除微珠背景)
|
表1.对照设置
|
组别
|
预期结果说明
|
|
Input
|
两条带均出现,证明蛋白X与Y均表达
|
|
IP组
|
仅X蛋白被沉淀,确认抗体有效,富集成功
|
|
Co-IP组
|
若Y蛋白也被检测到,证明X与Y互作成立
|
|
IgG组
|
无条带,无非特异结合
|
若IgG组出现Protein Y信号,需优化洗涤条件或更换抗体。
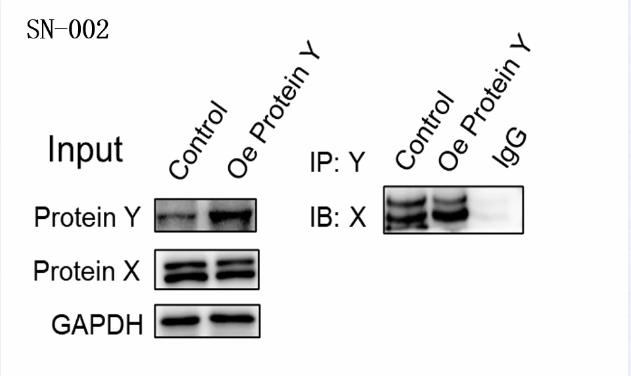
实验人:中国医科大学陈老师
样品类型:C2C12细胞
样品量:5×106 个细胞
蛋白提取方法:
SN-002:Invent柱式法MinuteTM IP/Co-IP实验蛋白提取试剂盒(800uL)
蛋白浓度:SN-002=4mg/mL
Input上样量:20ug
结果解读:
ProteinX可与ProteinY结合,当过表达ProteinY(Oe Protein Y组)时,ProteinX与ProteinY结合量增多。
避免过度裂解:避免使用RIPA、SDS或高浓度离子型去垢剂配方裂解液,避免超声,防止破坏蛋白互作。
推荐使用Invent柱式法MinuteTM IP/Co-IP实验蛋白提取试剂盒(Cat#SN-002),温和的裂解配方和离心管柱技术配合,可保持蛋白天然构象,保留蛋白互作的同时,更大限度的提取蛋白,减少蛋白丢失。
低温操作:全程冰上或4°C,防止蛋白降解。
抗体选择策略:推荐使用多克隆抗体捕获(结合力强),单克隆抗体检测(特异性高)。若无合适抗体,可使用FLAG、HA、Myc、GFP等标签,配合相应抗体进行IP。
抗体用量:建议梯度优化(1–5 μg),避免过量导致非特异结合。
珠子选择:样品量<2 mL推荐磁珠;>2 mL推荐琼脂糖珠。Protein A/G需根据抗体种属选择。
交联处理(可选):弱互作时可先用DSP交联剂固定复合
|
问题
|
可能原因与解决方案
|
|
高背景
|
增加洗涤次数、使用更温和裂解液、减少beads用量。
|
|
无信号
|
检查抗体是否适用于IP、裂解液配方是否能保持蛋白活性、如蛋白提取效率差需提高细胞起始量、转染后48–72h收样。
|
|
轻重链干扰
|
WB检测时选择与IP抗体不同种属的二抗,或使用重链/轻链特异性二抗。
|
|
IgG对照有条带
|
存在非特异结合,建议预清洗beads、优化孵育条件。
|

与我沟通,了解更多!



 站内热点
站内热点