WB 是一种用于检测蛋白质以及蛋白质翻译后修饰的常用方法,可以对简单或复杂生物样品中的目标蛋白质进行半定量或定量分析。
蛋白样品制备是 WB 实验的第一步,也是 WB 成功的关键步骤。但大家通常认为样品制备很简单,且方法单一,出错率极低,所以当 WB 失败时往往仅改变操作条件而忽视样品问题。其实 WB 实验内参不齐或检测不到、背景高、磷酸化蛋白检测困难、小 / 大分子量蛋白,脂化和膜相关蛋白无法检出等问题,都有可能是样品制备无效导致的,所以一定要注意样品制备中的细节,以保证蛋白样品的质量!
下面就为大家详细盘点一下从细胞,组织,培养基上清及血清血浆中制备样品的常见问题及注意事项。
一、 细胞样品
1. 细胞收集
悬浮细胞通过低速离心后收集进行蛋白提取。贴壁细胞可在培养器皿中直接进行蛋白提取,如器皿不易操作也可收集细胞后再进行蛋白提取。
Tips:贴壁细胞收集是刮下来好还是胰酶消化好?
两种方式都是可行的,各有利弊。胰酶消化可能会对某些膜蛋白产生影响,刮刀收集效率会略低,可根据自己的实验来选择细胞收集的方式。
2. 样品清洗
细胞样品在提取前需使用 PBS 清洗两遍,以减少培养基对样品的干扰(去除含血清培养基中的 BSA 及酚红指示剂等干扰)。
3. 细胞计数
蛋白提取前应进行细胞计数,用于确定需添加裂解液的量。合适的裂解液用量既能让细胞完全裂解,又可保证蛋白浓度,从而获得最佳提取效果。
4. 裂解液用量
Tips:裂解液加多少合适呢?
建议每1*106个细胞(NIH3T3 和 293T 细胞 10 ul 湿体积相当于1*106个细胞),加入 100 ul 裂解液为宜。可以根据不同细胞和具体实验条件进行摸索和调整。
5. 抑制剂的添加
抑制剂即加即用为好,可按蛋白酶 / 磷酸酶抑制剂原液倍数添加。例如:原液是 100x,则 1 ml 裂解液中添加 10 ul 抑制剂即可。
Tips:提蛋白时一定要加蛋白酶抑制剂和磷酸酶抑制剂吗?
蛋白酶抑制剂并非一定要加,但蛋白样品如果长期保存,或者下游实验过程较长,建议加入蛋白酶抑制剂。做磷酸化研究,一定要加入磷酸酶抑制剂!
6. 制备方法选择
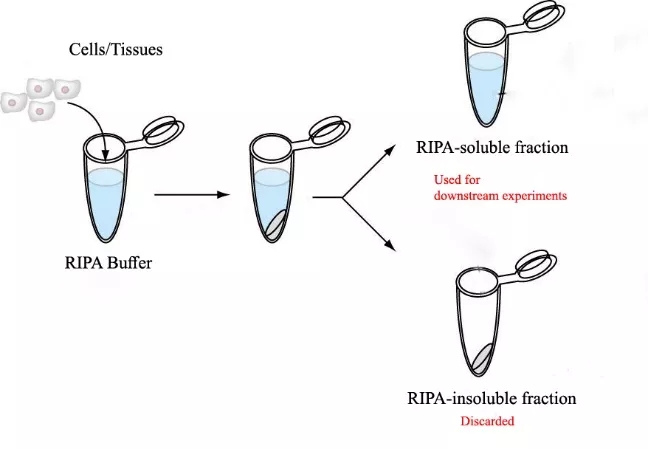
WB 实验不要求蛋白具有活性,可选择能充分溶出所有蛋白质的裂解液配方,且应尽量去除样品中的细胞碎片和核酸残团。目前蛋白制备方法可分为裂解液法和柱式法两种。裂解液法蛋白提取(如 RIPA)为防止 DNA 完全解链致使样品粘稠无法处理,故裂解液效率较低,仅能提取样品中的可溶性蛋白(即上清部分,沉淀部分为不可溶性蛋白及核酸残团),而非总蛋白。柱式法蛋白提取(如 Invent SD-001)使用优化的裂解液配方提高样品裂解液效率的同时,利用离心管柱技术有效处理粘稠的核酸残团,不产生沉淀,1 分钟可获得高质量的总蛋白样品。如遇到样品粘稠无法处理,或研究膜蛋白,核蛋白等难溶蛋白时,尽量选择柱式法蛋白提取。
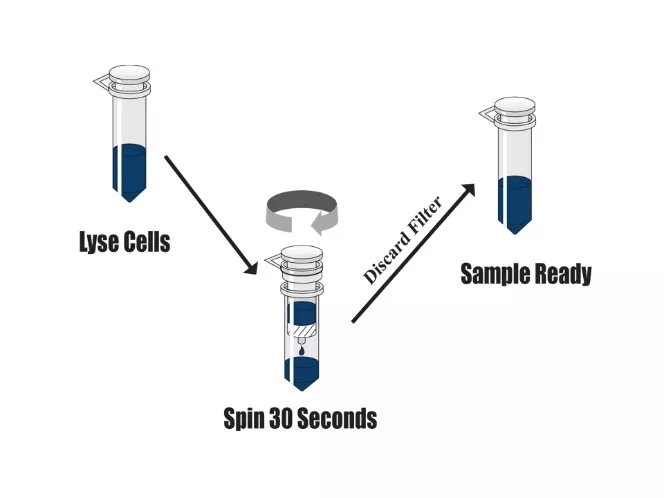
7. 样品裂解
加入裂解液后,可反复吹打与样品充分接触混匀,以确保样品中的蛋白zui大程度溶解于裂解液中。如使用裂解液法提取,离心后要避免扰动沉淀,小心吸取上清保存待用。
二、 组织样品
1. 样品取样与保存
组织样品的取样与保存非常关键,组织样品推荐的取样顺序:zui先取消化系统相关的组织(如胃、大小肠、肝脏、胰腺等)和富含巨噬细胞的组织(如肺),然后取生殖相关的组织(如卵巢、子宫、睾丸等),最后取心、脾、肾、脑等器官。肠道样品及含血丰富的样品,取样前可先进行灌洗等处理。取下的组织可以剪切成小块,如不马上使用,需冻存在液氮或 -80 度冰箱里。
2. 样品清洗
组织样品在提取前也需要用 PBS 清洗去除杂质和血液。一些含血量丰富的组织,建议使用红细胞裂解液(Invent WA-007)去除红细胞,以避免血液中 IgG 对后续实验的影响。
3. 样品使用量
组织样品需先称重,一般一次提取 15~20 mg 为宜,过多的样品会影响匀浆效果,增加细胞碎片数量,产生裂解不全等问题。
4. 样品匀浆
不同于细胞样品,组织样品提取时需要进行匀浆。可使用手动匀浆,也可使用机械匀浆。但通常匀浆方式和过程没有统一要求。使用不同的匀浆方式,匀浆力度和匀浆次数,均会造成人为误差,致使 WB 结果重复性差。所以使用何种方式匀浆需慎重选择。匀浆是为了使裂解过程更容易,但如裂解液效率不足,匀浆仅可增加可溶性蛋白的溶出,但难溶的蛋白(如膜蛋白,细胞器蛋白,核蛋白等)仍无法完全溶出。故需要根据样品和研究情况选择合适的提取方法。例如脑组织样品,较为柔软易匀浆可以手动完成,而皮肤,骨骼,韧带,血管等样品,匀浆极其困难,裂解效果差,建议选择专用试剂盒为好。
5. 裂解液用量
通常建议每 10 mg 样品,加入 100 ul 裂解液为宜。
抑制剂的添加,制备方法选择及样品裂解方式与细胞样品相同。
三、培养基上清
WB 检测分泌型蛋白时,理论上直接使用培养基上清检测最为理想。但通常分泌型蛋白含量较低,且含血清的培养基中含有非常丰富的 BSA(牛血清白蛋白,66 KDa)。当目标蛋白在 40~60 kDa 之间时,WB 检测会受到较为严重的干扰。因此建议采用无血清培养基培养后收集上清,然后利用沉淀方法进行分泌型蛋白富集,富集的沉淀重悬溶解后使用。传统沉淀方法主要是 TCA / 丙酮沉淀法,但其对蛋白质浓度较低的样品效率很低,蛋白损失较大。推荐使用沉淀方法:Invent WA-006 MinuteTM 蛋白沉淀试剂盒。低浓度的蛋白样品可以有效沉淀和浓缩,且沉淀的蛋白质很容易重悬溶解于含表面活性剂的溶液中。
需注意:
Tips:无血清培养基在任何情况下都可以使用吗?
无血清培养基可能会改变细胞的生理状态(可能激活未知信号途径,诸如 AKT 等),所以需根据自身实验考虑是否使用。
四、血清血浆
血清血浆中含有大量白蛋白,占血液中总蛋白质的 50~60%。所以用血清血浆样品做 WB 时,低丰度蛋白检出率极差,白蛋白会严重干扰电泳分辨率及转膜效率。所以血清血浆样品进行 WB 前,去除白蛋白可有效提高其他低丰度蛋白检出效率。推荐使用白蛋白去除方法:Invent WA-013 MinuteTM 血清血浆样品白蛋白去除试剂,可以处理几微升到几毫升的样品。90% 以上的白蛋白可以在不到 5 分钟内被除去。
Tips:蛋白样品如何储存?
以上各类样品蛋白制备完成后,推荐使用 BCA 法进行蛋白浓度测定,随后在样品中加入 loading buffer 混匀,煮样 3~5 分钟后冰上静置少许时间进行低速离心,即可上样。剩余样品建议分装后保存,样品可以在 4℃ 冰箱短时间保存,也可以在 -20 或 -80℃ 保存,解冻后可重新煮沸上样。
WB 实验步骤比较繁琐,细节决定成败,掌握了以上样品制备方法,加上科学的对照设置,正确的抗体选择,细致的实验操作和每步监测,定会获得 WB 的成功!
如需了解更多详情,请联系——010-58207790




 站内热点
站内热点