磷脂酰肌醇3-激酶(PI3K)是一种胞内磷脂酰肌醇激酶,同时具有丝氨酸/苏氨酸(Ser/Thr)激酶和磷脂酰肌醇激酶的活性,其可参与增殖、分化和葡萄糖转运等多种细胞功能的调节。Akt是一种丝氨酸/苏氨酸特异性蛋白激酶,在细胞存活和凋亡中起重要作用,经研究表明PI3K-Akt信号通路在人类肿瘤谱中普遍失调,该通路某些因素的突变导致的功能获得或功能缺失,从而引起细胞转化,同时可调节肿瘤细胞的增殖和存活,并与肿瘤的侵袭转移行为密切相关。
PI3K-Akt信号的激活一般是受到酪氨酸激酶和G蛋白偶联受体的刺激后,PI3K的p85调节亚基即被募集到邻近质膜的部位,p110亚基通过与p85亚基结合把底物4,5-二磷酸磷脂酰肌醇(PIP2)转化为三磷酸磷脂酰肌醇(PIP3)。PIP3可以和Akt的N端PH结构域结合。使Akt从细胞质转移到细胞膜上,并在3-磷酸肌醇依赖性蛋白激酶1(PDKI)和3-磷酸肌醇依赖性蛋白激酶2(PDK2)的辅助下,分别使Akt蛋白上的苏氨酸磷酸化位点(Thr308)和丝氨酸磷酸化位点(Ser473)磷酸化而使其激活。
长期以来,人们一直认为PI3K-Akt信号在细胞表面受体激活后的下游反应发生在质膜上,而2020年11月威斯康星大学麦迪逊分校医学与公共卫生学院的Thapa和Chen博士发表在《Nature Cell Biology》(IF=20.042)上《Phosphatidylinositol 3-kinase signalling isspatially organized at endosomal compartments by microtubule-associated protein4》一文揭示了内体上PI3Kα介导的PIP3合成的激活,其取决于PI3Kα与微管结合蛋白MAP4间的相互作用。
研究者运用激动剂刺激PI3K-Akt信号传导的经典模型发现MAP4对PI3K-Akt信号在内体上传导的调控作用。
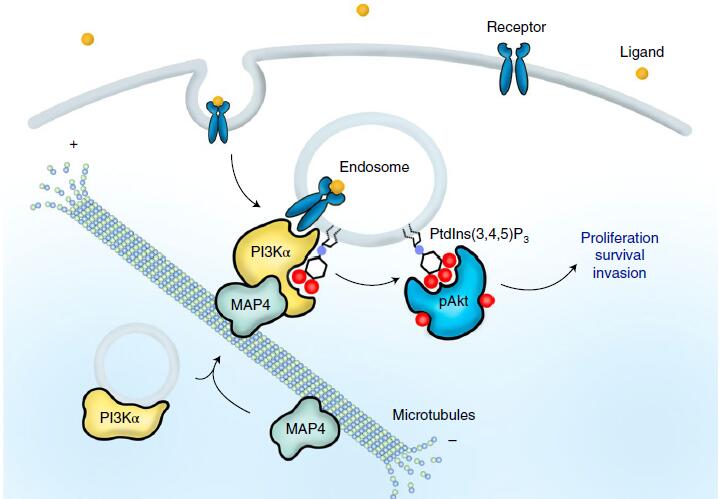
★PI3Kα分布在沿微管的小囊泡上,PI3Kα与MAP4的直接作用可促进PI3Kα沿着微管分布
★PI3Kα-MAP4复合物在受到受体酪氨酸激酶的刺激后,使得内体中的PI3Kα活化
★MAP4的缺失会干扰PI3Kα募集到微管和内体上,影响PI3Kα与激活受体复合物的结合,并减少PI3Kα的在内体中活化、PIP3的合成导致PI3K-Akt的信号传导的失调
主要结论:
(1)激动剂刺激PIP3的生成和Akt的激活发生在沿微管的内膜区室中
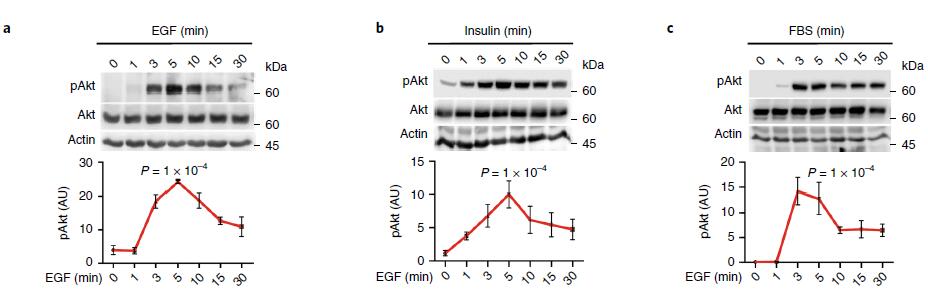
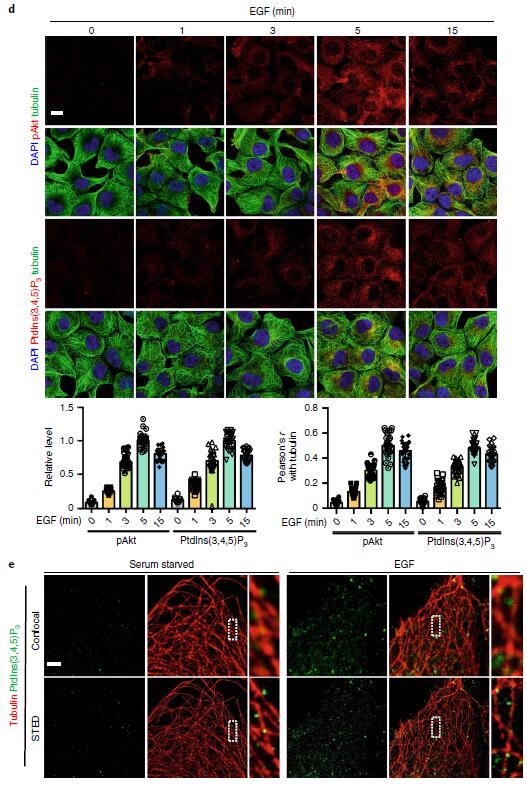
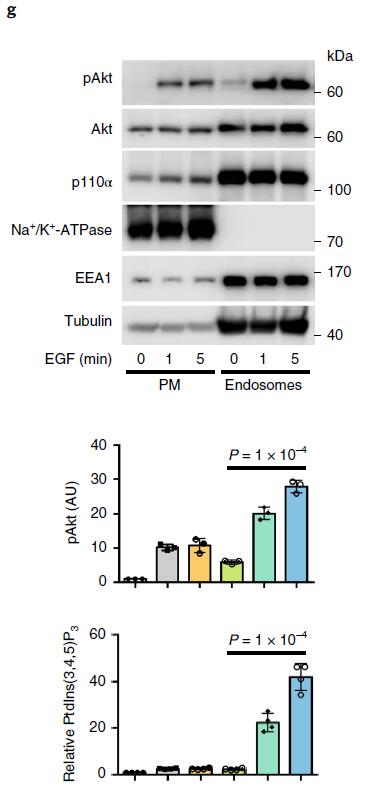
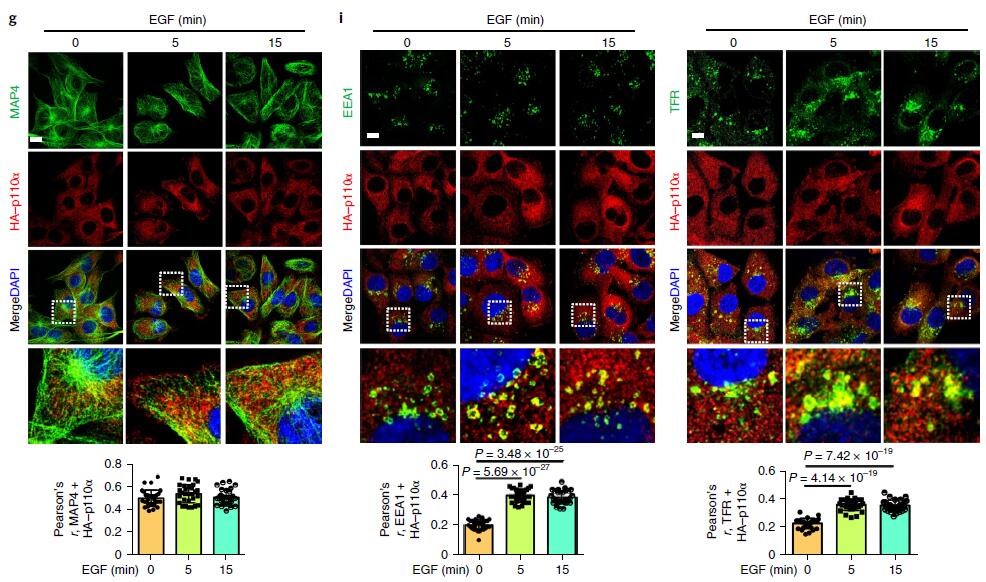
激动剂刺激细胞后,PI3K-Akt信号迅速启动,Akt信号在约5min时达到峰值(下图a,b,c),活化的Akt主要沿微管定位在囊泡结构上(下图d),以上结果表明激动剂刺激后,Akt的激活主要发生在细胞内体区室中;与Akt激活一致,EGF刺激细胞后生成的PIP3在5min达到峰值,并且也沿微管定位在囊泡区室(下图d,e),使用柱式法亚细胞分离技术分离细胞质膜组分以及内体组分,WB证明了EGF刺激细胞诱导的内体组分中PIP3生成和Akt的活化(下图g)。
(2)MAP4是PI3Kα的互作伴侣
PI3Kα和PIP3的生成定位在微管附近的内部囊泡中,表明与PI3Kα相互作用的蛋白质可以将PI3Kα沿微管连接到内部囊泡。PI3Kα免疫沉淀物的质谱分析确定了MAP4是PI3Kα的互作伴侣,MAP4是普遍表达的非神经元微管相关蛋白(下图a,b)。

(3)内体中MAP4-PI3Kα相互作用的调节
为了了解激动剂刺激后PI3Kα和MAP4的空间定位,作者研究了EGF刺激后PI3Kα和MAP4的亚细胞分布,MAP4和PI3Kα主要集中在微管中心及周围;使用免疫荧光显微镜观察,未观察到PI3Kα与MAP4的分布或共定位发生任何变化(下图g)。PLA法检测到MAP4和p110α之间的相互作用显着增加,而与p85亚基则没有(下图h)。以上结果表明PI3Kα囊泡的一部分位于内体中,在激动剂刺激被激活后可能与MAP4相互作用。
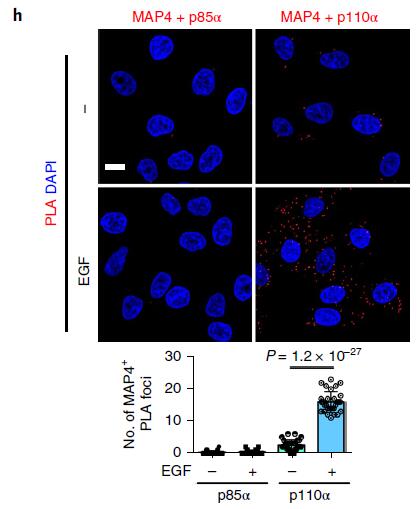
(4)MAP4对于Akt活化是必须的
通过WB对细胞质膜组分和内体组分验证MAP4敲低对EGF刺激细胞内体中Akt活化的影响(下图f)。Akt的活化主要发生在细胞内体中,MAP4的缺失会降低Akt活化,进而影响细胞的增殖以及侵袭。
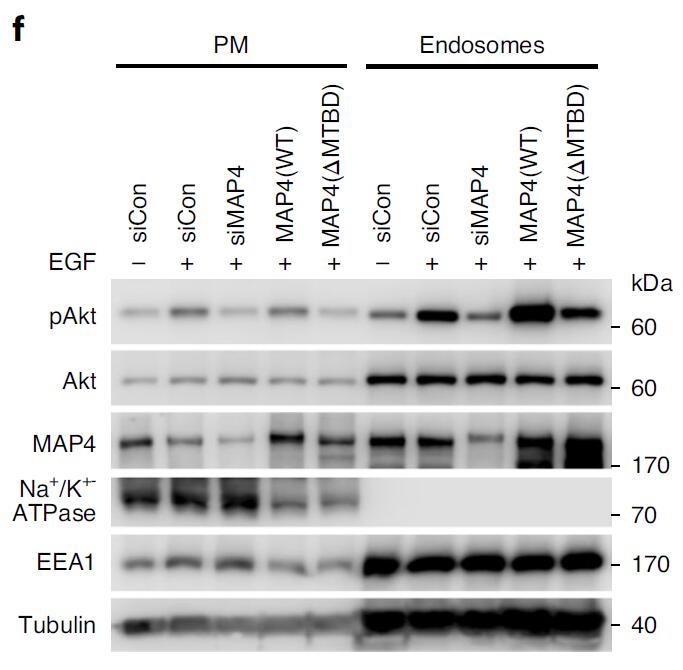
作者最终验证MAP4的敲低可以减少多种肿瘤细胞系中Akt介导的细胞增殖以及侵入性,提示其在癌症治疗中潜在的靶向性。
这项工作揭示了MAP4是内体中PIP3-Akt信号传导的关键调控子,并揭示内体与微管的密切关系,同时这项发现拓宽了我们对空间上和时间上磷酸肌醇信号传导的理解。
在这里我们需要重点提出一点:细胞外大分子、配体/受体复合物、功能膜蛋白和膜脂等通过内吞作用内化进入细胞,随后在胞内的囊泡状或管状膜性内体结构中进行一系列分选和定向运输。无论货物分子内吞进入细胞的方式如何,通常都运送到早期内体进行分选后进行转运(神秘的内体—内吞转运的来龙去脉)。验证信号传导,蛋白转运过程,我们通常需分离得到相对纯净的亚细胞结构。INVENT始终致力于柱式法亚细胞分离工具的开发,助力研究者精准而又简便地获得交叉污染较少的亚细胞结构,本文中使用了Invent柱式法分离了质膜组分(Cat#SM-005)和内体组分(早期内体,Cat#ED-028),从而验证质膜和内体上信号传导过程的假设。
Invent柱式法快速蛋白提取及亚细胞结构分离,助力信号传导,蛋白转运研究好帮手!(点击这里了解更多)
|
Invent亚细胞结构分离全攻略
|
|
SM-005(质膜及组分分离)
|
Minute™ Plasma Membrane Protein Isolation and Cell Fractionation Kit
|
|
ER-035(肝脏内质网)
|
Minute™ High Fidelity ER Isolation Kit for Liver Tissue
|
|
ER-036(内质网)
|
Minute™ ER Enrichment Kit For Tissues and Cultured Cells
|
|
GO-037(高尔基体)
|
Minute™ Golgi Apparatus Enrichment Kit
|
|
LY-034(溶酶体)
|
Minute™ Lysosome Isolation Kit for mammalian cells/tissues
|
|
ED-028(早期内体)
|
Minute™ Endosome Isolation and Cell Fractionation Kit
|
参考文献:
[1]NarendraThapa, Mo Chen, Hudson T. Horn1,et al.Phosphatidylinositol 3-kinase signalling is spatiallyorganized at endosomal compartments by microtubule-associated protein 4.NatureCell Biology.22,1357-1370(2020).
[2]Alex G.Batrouni, Jeremy M. Baskin.A MAP for PI3K activation on endosomes. NatureCell Signalling.22,1289-1294(2020).
[3]林珑,史岸冰.细胞内吞循环运输通路及其分子调控机制.[J]遗传.41,451-468(2019).









 站内热点
站内热点