内质网应激
内质网是细胞内蛋白质合成和折叠的重要场所。在正常情况下,新合成的多肽链进入内质网后,会在这里进行正确的折叠和修饰。然而,当细胞受到各种不良因素影响时,比如缺氧、营养缺乏、感染、氧化应激等,内质网内未折叠或错误折叠的蛋白质会积累。这些不良因素会干扰蛋白质的正常折叠过程,使内质网无法及时处理大量异常蛋白质,从而引起内质网应激(endoplasmic reticulum stress)。
内质网应激是细胞的一种保护性应激反应
当内质网应激发生时,细胞启动了一系列的保护机制来恢复内质网的正常功能。其中最重要的就是三条主要的信号通路(PERK 通路、IRE1 通路、ATF6 通路)。这些通路通过调节蛋白质折叠相关基因的表达、抑制蛋白质的翻译以及促进未折叠或错误折叠蛋白质的降解等多种方式,试图恢复内质网内蛋白质的稳态。
例如,在轻度内质网应激时,这些通路可以使细胞内质网的蛋白质折叠能力增强。细胞会合成更多的分子伴侣,如 BiP(结合免疫球蛋白蛋白),帮助未折叠或错误折叠的蛋白质正确折叠。同时,减少错误蛋白质的产生,如通过 PERK 通路抑制蛋白质的翻译,降低内质网的负担。
内质网应激信号通路
内质网应激主要有以下三条信号通路:
1. 未折叠蛋白反应(UPR)通路(PERK通路)
激活过程 :当内质网中积累大量未折叠蛋白时,内质网跨膜激酶 / RNase PERK(双链 RNA 激酶样内质网激酶)被激活。未折叠蛋白与 BiP(一种分子伴侣蛋白)分离并与 PERK 结合,激活 PERK。激活后的 PERK 可磷酸化真核翻译起始因子eIF2α,导致eIF2α失去活性。
下游效应 :磷酸化后的eIF2α会抑制大多数 mRNA 的翻译起始,从而减少新蛋白质的合成,避免内质网中蛋白质积累进一步加重,缓解内质网应激。同时,部分特定转录因子如 ATF4(激活转录因子4)等的翻译会增加。ATF4可激活多种基因表达,包括参与氨基酸代谢、抗氧化反应以及细胞凋亡相关的基因等。在细胞应对内质网应激和维持细胞生存中起到双向调控作用。
2. 未折叠蛋白反应(UPR)通路(IRE1通路)
激活过程 :IRE1(肌醇需求酶1)是另一种内质网跨膜蛋白激酶。在内质网应激时,未折叠蛋白与BiP分离并与IRE1结合,导致IRE1的激活。激活后的IRE1具有RNase活性,可以剪切细胞内的XBP1(X箱结合蛋白1)mRNA,切除一段26或24个核苷酸的片段。
下游效应 :剪切后的XBP1 mRNA经翻译产生具有转录活性的XBP1s,会转位到细胞核,激活一系列基因的转录,如参与蛋白质折叠、转运、内质网相关降解(ERAD)等过程的基因,从而增强细胞对内质网应激的适应能力,恢复内质网的正常功能。此外,IRE1还可以通过其他途径如激活 JNK(c-Jun N-末端激酶)信号通路等来调节细胞的凋亡或存活相关基因。
3. 未折叠蛋白反应(UPR)通路(ATF6通路)
激活过程 :ATF6(激活转录因子6)是一种内质网跨膜转录因子。正常情况下,ATF6与BiP结合处于非活化状态。内质网应激时,ATF6与BiP的结合减少,BiP从ATF6上解离,使ATF6暴露其疏水结构域,随后ATF6从内质网转运至高尔基体,在高尔基体中被S1P及S2P两种蛋白酶切割,产生具有转录活性的ATF6片段。
下游效应 :切割后的ATF6 N端结构域进入细胞核,促进含ERSE的转录因子(如XBP1)及UPR靶分子(如BIP)等基因转录。从而帮助细胞应对内质网应激,恢复蛋白质折叠平衡。
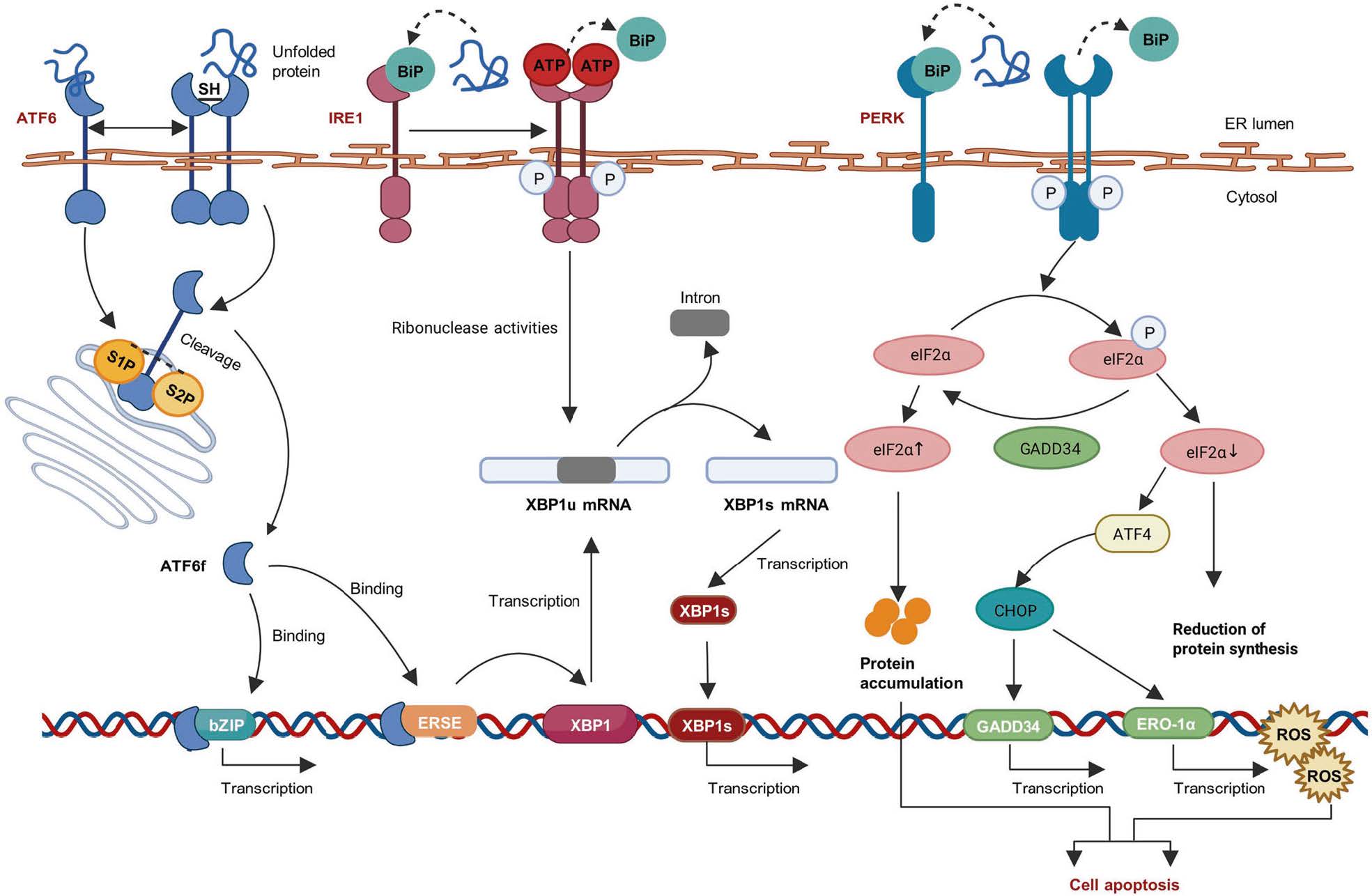
Fig. Unfolded protein response signaling pathways
图片来源:doi.org/10.1038/s41392-023-01570-w
这些信号通路相互协作,在一定程度上帮助细胞应对内质网应激,使其恢复蛋白质折叠和运输的正常功能。但如果内质网应激持续过长时间或过于严重,这些通路的激活可能会导致细胞凋亡,以此来清除受损严重的细胞,避免对机体造成更大的危害。
内质网应激信号通路的验证
分子生物学方法
检测基因转录水平:
实时定量PCR(qPCR):通过设计特异性引物,amplification内质网应激相关基因,如BiP、CHOP、XBP1等的mRNA表达量。在内质网应激条件下,这些基因的转录水平通常会发生显著变化。例如,使用 qPCR检测细胞在tunicamycin或thapsigargin等内质网应激诱导剂处理后,上述基因的mRNA表达量变化,若其表达量明显上调,则可初步判断细胞发生了内质网应激反应,并且相关信号通路被激活。
RNA-seq:对细胞或组织样本进行高通量测序,可全面分析内质网应激状态下基因表达谱的变化,一次性获得大量基因的表达信息,包括已知和未知的转录本。通过与正常状态下的样本进行比较,筛选出在内质网应激时差异表达的基因,进而挖掘可能参与内质网应激反应的信号通路及相关分子机制。
分析蛋白表达及修饰:
Western Blot:检测内质网应激相关蛋白的表达水平及修饰状态,如 PERK、IRE1、ATF6等的表达量及其磷酸化水平,以及下游蛋白如 eIF2α、ATF4、CHOP等的表达变化。例如,检测细胞在内质网应激诱导剂处理后,PERK和 eIF2α的磷酸化水平是否升高,ATF4和CHOP的蛋白表达量是否增加,若结果呈阳性,则表明PERK-eIF2α-ATF4-CHOP信号通路可能被激活。
验证注意事项:
验证内质网应激的指标需要根据不同蛋白的定位和研究目的选择合适的蛋白分离方法,以获得更准确、有针对性的检测结果。
以下是常见的分离方案:
*总蛋白提取
对于一些在细胞内普遍存在或分布较广的蛋白,如 BiP/GRP78、CHOP、eIF2α等,可以提取细胞的总蛋白进行检测。总蛋白提取方法相对简单,能够快速了解这些蛋白在细胞内的整体表达水平变化情况。
相关推荐:Invent柱式法总蛋白提取工具
(Cat#SD-001/SN-002)可快速有效1分钟完成总蛋白提取,且无蛋白丢失。
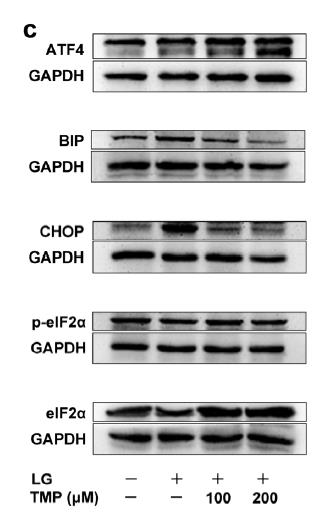
Fig.Western blotting shows the relative protein expression levels of ATF4, BIP, CHOP, and p-eIF2α/eIF2α. LG, low glucose (0.5 g/L)
图片来源:doi.org/10.1007/s00109-020-02017-3
*内质网蛋白分离
PERK、IRE1α等位于内质网膜上的蛋白,以及内质网腔内的蛋白如 BiP/GRP78、Calnexin、Calreticulin 等,为了更精准地研究它们在内质网应激条件下在内质网中的表达和修饰状态,可以采用内质网蛋白分离技术。
相关推荐:Invent柱式法内质网分离工具
(Cat# ER-036)分离出内质网蛋白,排除其他细胞组分的干扰,更准确地检测这些蛋白的变化。
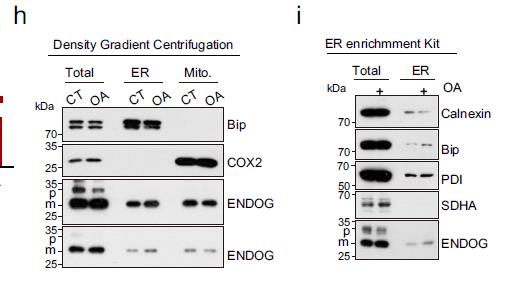
Fig.ENDOG activates ER stress by translocating to the ER and binding with Bip.
图片来源:doi.org/10.1038/s41467-023-41757-x
*高尔基体蛋白分离
部分内质网应激相关蛋白可能与高尔基体有关联,比如在内质网应激时,ATF6从内质网转运至高尔基体并被切割激活。分离高尔基体蛋白可以研究ATF6在高尔基体中的切割和激活情况,以及其他可能与高尔基体相关的蛋白在内质网应激中的变化。
相关推荐:Invent柱式法高尔基体分离工具
(Cat# GO-037)
*细胞核蛋白分离
一些转录因子如 ATF6 片段、XBP1s等在内质网应激时会进入细胞核调节基因表达。为了检测这些蛋白在细胞核内的积累和活性,需要分离细胞核蛋白进行分析。
相关推荐:Invent柱式法胞浆和胞核分离工具
(Cat# SC-003)将细胞核与其他细胞组分分离开,提取细胞核蛋白,以准确检测转录因子等蛋白在细胞核内的表达水平和转录活性。
免疫共沉淀(Co-IP):验证内质网应激信号通路中蛋白与蛋白之间的相互作用。例如,通过Co-IP实验可检测IRE1与TRAF2、ASK1 等蛋白在内质网应激条件下的结合情况,若能检测到这种相互作用增强,则说明IRE1信号通路中的相关蛋白相互作用被促进,进而可能激活下游的凋亡信号通路。
双荧光素酶报告基因检测:构建含有内质网应激相关基因启动子区域的报告基因质粒,将其转染入细胞,然后用内质网应激诱导剂处理细胞,通过检测荧光素酶的活性来反映目的基因启动子的活性变化。如将含有 XBP1启动子的报告基因质粒转染细胞后,检测细胞在内质网应激刺激下荧光素酶活性是否升高,若升高则表明内质网应激可激活XBP1基因的转录,进而推断IRE1-XBP1信号通路被激活。
细胞生物学方法
荧光报告基因检测:利用荧光蛋白标记内质网应激相关蛋白或细胞器,通过荧光显微镜或流式细胞仪观察荧光信号的变化来监测内质网应激的发生和信号通路的激活。例如,将红色荧光蛋白mCherry与内质网应激相关蛋白如 PERK、IRE1等融合表达,观察在内质网应激诱导剂处理后,荧光信号在细胞内的定位和强度变化,若荧光信号增强或出现特定的细胞内分布改变,则可直观地显示相关蛋白在内质网应激时的激活状态和分布情况。
细胞活性及凋亡检测:内质网应激过度或持续时间过长会导致细胞凋亡。可通过 CCK-8、MTT等方法检测细胞活性,以及用流式细胞仪检测细胞凋亡率,来评估内质网应激对细胞生存的影响,从而间接反映内质网应激信号通路的激活状态。例如,若在内质网应激诱导剂处理后,细胞活性降低,凋亡率升高,同时检测到与凋亡相关的内质网应激信号通路蛋白如CHOP、BAX 等表达增加,则可表明内质网应激信号通路中的凋亡途径被激活。
钙离子浓度检测:内质网是细胞内钙储存的重要场所,内质网应激常伴随着钙稳态的失调。采用荧光钙指示剂如Fluo-3/AM或Indo-1/AM等,通过荧光显微镜或流式细胞仪检测细胞内钙离子浓度的变化,观察在内质网应激条件下钙离子是否从内质网释放到细胞质中,若钙离子浓度升高,则可作为内质网应激发生的一个重要指标,同时也可能与内质网应激信号通路的激活有关。
体内实验方法
动物模型构建与观察:通过构建内质网应激相关的疾病动物模型,如利用高脂饮食诱导肥胖模型、化学药物诱导的器官损伤模型等,观察动物体内组织器官的病理生理变化以及内质网应激信号通路的激活情况。例如,在高脂饮食诱导的肥胖小鼠模型中,检测肝脏组织中 BiP、CHOP、PERK等蛋白的表达水平,以及相关基因的转录情况,若发现内质网应激信号通路被激活,同时伴随肝脏脂肪变性等病理变化,则可验证内质网应激信号通路在该疾病发生发展中的作用。
基因敲除或过表达动物模型:利用基因工程技术构建特异性敲除或过表达内质网应激信号通路关键基因的动物模型,研究其在正常生理条件和疾病模型中的表现。例如,构建ATF6或IRE1基因敲除小鼠,观察其对内质网应激诱导剂的反应性以及在相关疾病模型中的易感性,若敲除小鼠表现出对内质网应激的敏感性增加或疾病表型加重,则可证明该基因在内质网应激信号通路中的重要作用。

扫码与我交流






 站内热点
站内热点